Unidad: Cinética y equilibrio químico
VELOCIDAD DE REACCIÓN
INTRODUCCIÓN A LA CINÉTICA
Yo entendí que la cinética química se ocupa del estudio de la rapidez con que se producen las reacciones químicas cualquier proceso químico puede descomponerse en una secuencia de pasos elementales.
Las reacciones elementales suelen implicar una sola colisión entre dos moléculas, cuando eso ocurra diremos que se trata de un proceso biomolecular. También es posible que únicamente haya implicada una molécula, casos de isomerización, disociación, en este caso diremos que la reacción es unimolecular.
En muy raras ocasiones, en condiciones de muy alta presión, puede darse el caso de una reacción trimolecular.
Uno de los puntos importantes que toca tener en cuenta es que muchas reacciones que se escriben como una sola ecuación sobre el papel, en realidad, consisten en una serie de pasos elementales. Esto será extremadamente importante a medida que aprendamos más sobre las teorías que intentan explicar los procesos globales en una reacción química.
MECANISMOS DE REACCIÓN
Lo que entendí fue que una vez que tenemos uno o más mecanismos posibles que cumplen con los criterios mencionados anteriormente, podemos comprobar si están respaldados por datos experimentales adicionales. Por ejemplo, si hay un producto intermedio en nuestro mecanismo propuesto, podríamos tratar de detectarlo en una mezcla de reacción. Es importante recordar que si no podemos observar un producto intermedio esperado, no necesariamente queda descartado el mecanismo, puesto que el producto intermedio podría estar presente en concentraciones que son demasiado bajas para poder detectarlo.
VELOCIDAD DE REACCIÓN
Para mi la velocidad de una reacción química relaciona el cambio en la concentración de reactivos o productos con el tiempo y se expresa, usualmente, en mol/l × s durante el transcurso de una reacción, las moléculas de reactivos van desapareciendo, al tiempo que se forman los productos. La velocidad de la reacción se puede estudiar observando la disminución de la concentración de reactivos o el aumento de la concentración de productos. En la reacción: su velocidad se establece midiendo la variación de la concentración de los reactivos o de los productos con el tiempo. Si se selecciona un producto, la expresión de la velocidad tiene signo positivo, ya que la variación de su concentración siempre es positiva.
LEY DE LA VELOCIDAD Y ORDEN DE REACCIÓN
Lo que vi fue que la velocidad de una reacción es
proporcional a la concentración de los reactivos, no todos ellos
influyen de la misma manera en la velocidad. La expresión que permite
calcular la velocidad a la que ocurre reacción y relacionar la velocidad con
las concentraciones de los reactivos se llama Ley de Velocidad.
Para determinar los órdenes parciales, se mide la
velocidad inicial de la reacción (variación de concentración en función al
tiempo) al variar las concentraciones iniciales de los reactivos, a cierta
temperatura.
La ley no dice que la velocidad depende directamente de las concentraciones de ambos reactivos. Existen casos en los que la velocidad no depende de la concentración de alguno de ellos (reacciones de orden cero), es decir, la velocidad es independiente de la cantidad de reactivo que se tenga.
ENERGIA DE ACTIVACIÓN
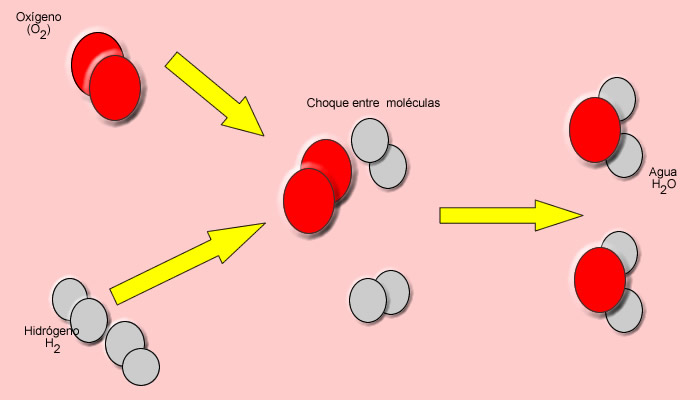
Lo que decía el video era que la energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Para superar esto se requiere energía (energía de activación), que proviene de la energía térmica del sistema, es decir la suma de la energía traslacional, vibracional, y rotacional de cada molécula.

Comentarios
Publicar un comentario